Об авторе
Воронин Егор Анатольевич — доктор философии (PhD) по биологии, старший научный сотрудник Международной компании по созданию вакцины против ВИЧ (Global HIV Vaccine Enterprise, Нью-Йорк, США). Автор и соавтор 18 научных работ.
Ход болезни у конкретного человека определяется рядом факторов: общим состоянием организма и перенесенными ранее заболеваниями, разновидностью попавшего в организм микроорганизма, особенностями генотипа больного, наличием сопутствующих инфекций и т. п. Любое инфекционное заболевание у разных людей протекает по-разному. Для большинства болезней статистика типичных симптомов и сроков их протекания не включает в себя случаи, когда заболевание прошло «мягко» или вообще бессимптомно. И хотя такие ситуации обычно выпадают из поля зрения медиков, именно они представляют особый интерес, потому что могут указать на неизвестные механизмы защиты от инфекций. В этом смысле не является исключением и ВИЧ-инфекция, которая на сегодня считается неизлечимым заболеванием.
Практически с самого начала эпидемии ВИЧ были отмечены редкие случаи, когда человек оказывался полностью устойчивым к вирусу либо носительство вируса у него не переходило в стадию СПИДа. Исследования показали, что «виноват» в этом поверхностный лимфоцитарный белок CCR5, а точнее, его отсутствие у некоторых людей.
Дело в том, что когда вирус ВИЧ попадает в организм, он стремится проникнуть в лимфоциты — важнейшие иммунные клетки крови, участвующие в защите организма от инфекций. Чтобы суметь проникнуть в лимфоцит, белок оболочки на поверхности вируса должен связаться с двумя клеточными белковыми рецепторами на поверхности лимфоцитов, одним из которых и является белок CCR5 (Deng et al., 1996). Оказалось, что некоторые люди являются носителями мутации, которая предотвращает синтез СCR5, и, соответственно, их лимфоциты оказываются устойчивыми к заражению большинством вариантов ВИЧ.

Могут существовать и другие механизмы невосприимчивости к ВИЧ, о которых мы просто не знаем. Так, коллектив французских ученых, работавший с группой из 1700 ВИЧ-инфицированных людей, недавно опубликовал результаты исследования двух необычных случаев устойчивости к инфекции, которые не были связаны с отсутствием белка СCR5 (Colson et al., 2014). В первом случае диагноз пациенту был поставлен еще в 1985 г., однако, хотя он и не принимал никаких антивирусных препаратов, стандартные анализы указали на полное избавление от вируса. Ни в крови, ни в культуре клеток крови этого человека не были обнаружены следы присутствия «живого» вируса.
Конечно, в первую очередь возник вопрос — а был ли пациент действительно инфицирован, или исследователи столкнулись с редкой диагностической ошибкой? Однако дополнительные анализы показали, что факт заражения имел место: в его крови были обнаружены антитела к ВИЧ и отдельные фрагменты вирусных белков, а также ничтожные количества вирусной ДНК, которую удалось определить лишь с использованием высокочувствительных методов.
Исследователи попытались заразить лимфоциты, взятые от этого пациента, «лабораторным» вариантом ВИЧ. Однако эта попытка не удалась, в отличие от контрольных лимфоцитов, взятых у других пациентов. В этот раз исследователи точно установили, что на лимфоцитах необычного пациента белок CCR5 присутствует, и поняли, что они имеют дело с новым механизмом блокировки репликации генома ВИЧ.
Возможный ключ к объяснению этого феномена был найден в тех небольших количествах вирусной ДНК, которые все же удалось выделить из крови пациента. Анализ их нуклеотидной последовательности показал, что этот вирусный геном просто напичкан мутациями. Мутированными оказалось около четверти кодонов*, кодирующих аминокислоту триптофан, которые в результате превратились в стоп-кодоны, останавливающие синтез белка.
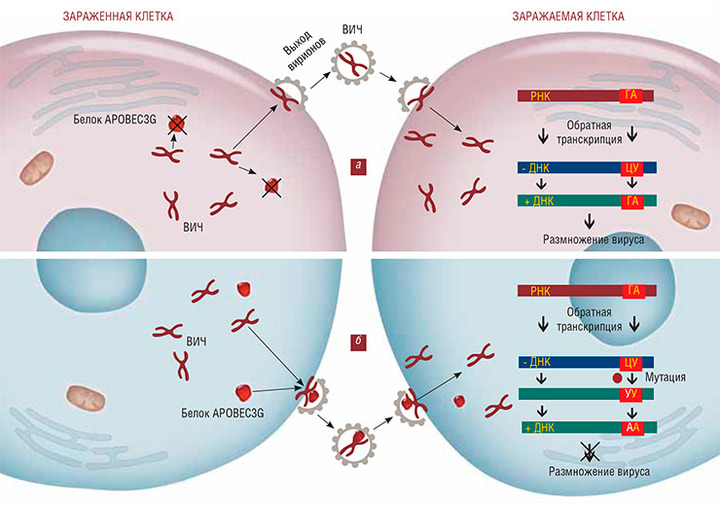
Собственно говоря, механизмы иммунной защиты, которые могли таким образом инактивировать вирус, уже известны. ВИЧ относится к вирусам с РНК-геномом, и чтобы размножиться, он должен пройти стадию обратной транскрипции, т. е. РНК должна превратиться в ДНК. «Перехватить» вирусный геном на этой стадии может группа клеточных белков из семейства APOBEC3G. Они «отрывают» аминогруппу (–NH2) от цитозиновых нуклеотидов, превращая их в урациловые. В результате в геноме вместо комплементарных пар нуклеотидов «цитозин — гуанин» появляются пары «урацил — аденин». А поскольку в кодон триптофана входят два гуанина, их замена на аденин превращает триптофановый кодон в стоп-кодон (Sheehy et al., 2002).
Обычно ВИЧ удается обойти этот уровень защиты: у него имеется специальный белок, который атакует и уничтожает APOBEC3G. Но почему-то на сей раз этого не случилось, и весь жизнеспособный вирус оказался мутирован до состояния полной потери функциональности.
Предположив, что этот случай может быть не единичным, исследователи стали искать среди своих полутора тысяч пациентов со схожим анамнезом. И нашли! У этого человека также не удалось стандартными методами обнаружить ДНК- или РНК-вирусы. В крошечных фрагментах вирусной ДНК, которые удалось обнаружить у него в крови, также присутствовало большое число мутаций, схожих с теми, которые были найдены в первом случае. Однако лимфоциты второго пациента оказались неустойчивы к заражению «лабораторным» вариантом ВИЧ, поэтому не исключено, что механизм устойчивости к вирусу у него иной.
Многообещающим направлением этой работы является дальнейшее исследование механизмов устойчивости лимфоцитов первого пациента в экспериментах по заражению «лабораторным» штаммом вируса. Предполагается, что у этого человека имеется редкий вариант гена APOBEC3G, который ВИЧ не способен обойти. Но хотя это и было бы интересной находкой, такое открытие, скорее всего, не будет иметь широкого практического применения, поскольку пользу от такой мутации могут получить только ее носители. Тем не менее остается надежда на то, что при исследовании обнаружатся какие-то неизвестные ранее иммунные механизмы защиты, что даст толчок к разработке новых лекарств или методов предотвращения инфекции ВИЧ.
Авторы этой работы выдвинули также гипотезу, что в защите клеток от повторного заражения ВИЧ свою роль могут играть «фрагменты» вируса в виде коротких белков, образующиеся в результате досрочной остановки белкового синтеза на новых стоп-кодонах. Эти белки могут осуществлять защитную функцию либо, например, конкурируя с какими-то необходимыми для вируса белками, либо каким-то особым образом стимулируя иммунитет. Высказано даже предположение, что наблюдаемое явление формирования вирусной устойчивости — это естественный процесс эндогенизации ВИЧ, т. е. эволюционный процесс, в результате которого вирусная нуклеиновая кислота становится частью генома другого вида (в данном случае — человека).
Это предположение не так уж и фантастично: наши геномы полны «следов» древних инфекций — заражений ретровирусами, которые умеют встраивать свой наследственный материал в нашу ДНК. Ведь если в геном носителя встраивается не патогенный, а инактивированный вирус, который к тому же дает защиту против повторной инфекции, то он имеет намного большие шансы распространиться в популяции. И если начать масштабный поиск людей, которые несут вирус с большим количеством инактивирующих мутаций, то у нас появится шанс наблюдать эндогенизацию ВИЧ в реальном времени.