Актуальность проблемы. Влияние некоторых антиретровирусных препаратов на когнитивную функцию ВИЧ-положительных остается мало изученным. Эфавиренз (EFV) достоверно вызывает когнитивные нарушения. Целью данного исследования было установить, оказывает ли постоянная терапия EFV определяющее влияние на нейрокогнитивные и нейрометаболические функции при выборе и назначении АРТ.
Методы. Мы проводили открытое контролируемое исследование IV фазы. Взрослые участники со стабильно подавленной нагрузкой на протяжении 6 месяцев и получающие АРТ на основе EFV были переведены на терапию лопинавиром/ритонавиром с прежней нуклеозидной основой. В начале исследования и через 10 недель после перевода на новую схему терапии оценивались следующие параметры: когнитивная функция (с помощью компьютерной системы CogState®); мозговые метаболиты (с помощью протонной магнитно-резонансной спектроскопии); активность мозга (с помощью функциональной магнитно-резонансной томографии на основе постановки задач по оценке внимания); качество и количество сна (с помощью дневника сна, Питтсбургский индекс качества сна и шкалы сна Эпворт).
Результаты. Шестнадцать человек прервали участие. Хотя большая часть участвовавших в исследовании (81%) отмечали проблемы с памятью на начальном этапе, данные когнитивных функций, мозговых метаболитов и мозговой активности, не показали изменений к 10-й неделе после смены схемы. Качество сна улучшилось после перехода со схем с EFV (средние значения PSQI (стандартниые отклонения): EFV 8,5 (6,5) LPV/r 5,8 (5,5), среднее изменение – 0,4; 95% доверительный интервал – от 6,0 до 0,7).
Выводы. Данное исследование является первым контролируемым исследованием, в рамках которого получены данные о влиянии длительной терапии EFV на неврологические функции. Мы пришли к выводу о том, что отмена EFV вряд ли окажет значимое влияние на изменение нейрокогнитивных функций у стабильных ВИЧ-положительных пациентов.
Введение
Умеренные когнитивные нарушения все еще остаются обычным явлением в эпоху высокоактивной антиретровирусной терапии. Однако причины этого до настоящего времени недостаточно понятны. В частности, относительно мало внимания исследователей уделено роли отдельных аниретровирусных препаратов в опосредовании когнитивных функций. Хотя подавление вирусной репликации в центральной нервной системе (ЦНС) является существенно важным, очевидно, что некоторые препараты имеют побочные нейротоксические эффекты. Эфавиренз (EFV) остается одним из самых широко используемых противовирусных препаратов. Известно, что побочные эффекты со стороны ЦНС (особенно нарушения сна) обычно проявляются в течение первых 6 недель приема EFV и иногда приводят к отмене, но в целом ослабевают по мере продолжения приема препарата. В некоторых недавних обзорных исследованиях сделаны предположения, что EFV может быть связан с повышенным уровнем когнитивных нарушений. Это предположение подтверждается некоторыми данными о нейротоксичности, полученными из опытов на животных и исследованиями in vitro. Гипотеза все еще противоречива и не получила подтверждения в контролируемых исследованиях.
В связи с этим целью этого исследования было определить, оказывает ли постоянная терапия EFV в рамках успешной АРТ определяющее влияние на нейрокогнитивные функции.
МЕТОДЫ
Участники
Мы провели пилотное самоконтролируемое открытое исследование IV фазы. Участниками были взрослые пациенты (возраст 18-65 лет) с ВИЧ-1 инфекцией получающие эффективный EFV-содержащий режим. Все обследования проводились одном исследовательском центе. Критериями включения были: вирусная нагрузка менее 50 РНК копий/мл в течение 4 месяцев, предшествующих началу исследования и отсутствие превышения вирусной нагрузки более 200 копий/мл в течение 12 месяцев. Участники были на АРТ по крайней мере 12 месяцев и на EFV по крайней мере 6 месяцев. Данное ограничение применялось для того, чтобы во внимание принимались только постоянные эффекты EFV. Из числа участников были исключены лица, указавшие на факт приема рекреационных наркотиков или еженедельное употребление алкоголя превышающее 35 единиц.
Все участники дали письменное информированное согласие на участие в исследовании. Исследование было одобрено местным комитетом по этике (12/NE/0071), комитетом трастового фонда больниц Ньюкастла-на-Тайне (5946) и Британским агентством по регулированию Лекарственных препаратов и продуктов для здоровья и зарегистрировано в базе данных исследований EudraCT (2011-005581-37).
Вмешательства и методы измерений
Препаратом сравнения для выявления эффектов исключения EFV был принят усиленный ритонавиром лопинавир (LPV/r, Калетра, AbbVie Inc., North Chicago, IL, USA, в дозировке 2 раза в день). Все участники были переведены с EFV на LPV/r. Участники прошли обследование на этапе начала исследования и через 10 недель после смены схемы. Дополнительный мониторинг безопасности проводился через 4 недели после смены схемы.
Компьютеризированная система когнитивного тестирования (CogState®, CogState Ltd, Мельбурн, Австралия) была представлена в составе шести тестов (приведены с сокращенным наименованием теста, когнитивной сферы, подвергшейся тестированию): распознавание (DET, психомоторные функции/скорость обработки), идентификация (IDN, визуальная внимательность/зоркость), обучение по одной карточке (OCL, визуальное восприятие и память), задача 1-назад (ONB, внимание/рабочая память), тест непрерывного спаренного ассоциативного обучения (CPAL, визуальное обучение/память), изучение лабиринтов Гротона (GML, исполнительные функции/решение пространственных задач). Участники прошли пробное испытание по каждому из тестов, чтобы минимизировать эффект обучения. Первичный уровень когнитивных нарушений определялся по шкале нормативных значений CogState® (за исключением CPAL, поскольку для данного теста пока нет достаточного количества качественных данных).
Протонная магнитно-резонансная спектроскопия (1H-MRS) была проведена с использованием объемного отбора (TR/TE (повтор время/эхо время) = 3с/37 мс) PRESS (спектроскопия точечного разрешения) на магните 3Т (Achieva; Philips Medical Systems, Amsterdam, Netherlands) отобранными вокселями объемом примерно 8 см3 фронтального белого вещества (FWM), фронтального серого вещества (FC) и базальных ганглиев (BG). Уровни метаболитов N-асетиласпартата (NAA), холина (Cho) и креатина (Cre) оценивались методом QUEST на программном комплексе jMRUI. Концентрации указывались относительно креатина (Cre). (Уровень) холина часто меняется при воспалении.
С помощью функциональной магнитно-резонансной томографии на основе постановки задач по оценке внимания (fMRI) оценивался ответ на тест Струпа используя несоответствующие визуальные стимулы. Тест Струпа продемонстрировал чувствительность к эффектам психотропных лекарственных средств, включая стимуляторы и седативные средства, также как и к приему EFV в одном из предшествующих исследований. fMRI проводилась с использованием градиентныой эхо EPI (эхо-планарной томографии) последовательности (повтор время/эхо время = 1,7с/30 мс, срезы 27*4,0 толщины, межсрезовое расстояние 0,5мм, разрешение в плоскости 3 мм) со сблокированным тестом Струпа. Данные собирались в единый fMRI массив, в котором формировались тома по 360 изображений. Стимулирование состояло из: периода отдыха, 18 чередующихся блоков несоответствующих и нейтральных стимулов и в завершающего периода отдыха. Контроль реакции исследуемого осуществлялся с помощью контрольной панели. Анализ снимков fMRI проводился с помощью стандартных режимов в smp8 (http://www.fil.ion.ucl.ac.uk/spm/software/spm8/). Анализ проводился в отношении каждого участника, показавшего различия в реакции на несоответствующие и нейтральные стимулы. Затем был проведен групповой анализ с применением метода спаренного сравнения реакций участника в каждый отдельный момент времени.
Сон оценивался на основе 2-х недельного дневника сна, заполнения шкалы сна Эпворта (ESS), где балл больше 10 означает чрезмерную дневную сонливость, и заполнением опросников по Питтсбургскому индексу качества сна (PSQI), где балл выше 5 означает некоторый уровень нарушения сна, а более 10 – значительное нарушение сна.
Статистка
В связи с тем, что исследование носило пилотный характер, анализ проводился по выборке прагматического размера. Приводится описательная статистика и доверительные интервалы (Cls). Не проводилось никаких замен данных или внесения недостаюищих.
Результаты
К участию в исследовании были приняты 17 человек, из которых 16 (3 женщины и 13 мужчин) прошли исследование полностью (один участник был исключен во время контрольного осмотра). Средний возраст составлял 50,4 года (межквартильный диапазон IQR 43,2 – 55,7 лет). Средняя давность установления диагноза ВИЧ-инфекции составляла 6,7 лет (IQR – 4.2 -10,0 лет), Участники принимали EFV в среднем 4,5 года (IQR 4.0 – 5,8 лет). На старте 14 участников получали базовую терапию на основе тенофовира/эмтрицитабина, оставшиеся двое – тенофовира/ралтегравира и абакавира/ламивудина, соответственно. Среднее значение уровня CD4+-Т-лимфоцитов в начале составляло 660 кл/мкл (IQR 536-737 кл/мкл). Средний надир (средний минимальный уровень) составлял 237 кл/мкл (IQR 37-299 кл/мкл, n = 12 участников с доступными данными по надиру). Среднее стартовое значение плазменной концентрации EFV составляло 2455 нг/мл (варьируя в пределах 818 – 7197 нг/мл, n=15 участников с доступными для анализа данными по уровням EFV).
Участники часто предъявляли жалобы на симптомы нарушения со стороны ЦНС как на старте исследования, так и в последующем, хотя характер симптомов менялся между визитами (n=16): проблемы с памятью (81 % участников на старте и 31 %в последующем), яркие/навязчивые сны (75% и 44%, соответственно), усталость (69% и 25% соответственно), сложность с концентрацией (63% и 75%, соответственно), проблемы со сном (56% и 81%, соответственно).
Девять участников (56%) демонстрировали признаки умеренных когнитивных нарушений на старте (по определению >1 стандартного отклонения (SD) ниже возрастной нормы (напр., z-балл < -1) по крайней мере в двух областях. Два участника показали существенные нарушения (z-балл < -2 по крайней мере в двух областях). Изменений в когнитивной деятельности между стартом и последующими визитами обнаружено не было. Средние значения изменений (позитивное изменение означает улучшение) для каждого из заданий был следующие (n=16): DET -0,03 (95% Cl: -0,09 до 0,04); IDN 0,03 (95%, Cl: -0,02 до 0,07); OCL 0,03 (95% Cl: -0,004 до 0,07); ONB -0,001 (95% Cl: -0,07 до 0,07); CPAL 13,6 (95% Cl: -9,8 до 37,0); GML 2,9 (95% Cl: -3,5 до 9,4) Обобщенная статистика когнитивных тестов приведена в таблице:
Таблица1. Нейрокогнитивное тестирование с помощью системы CogState®
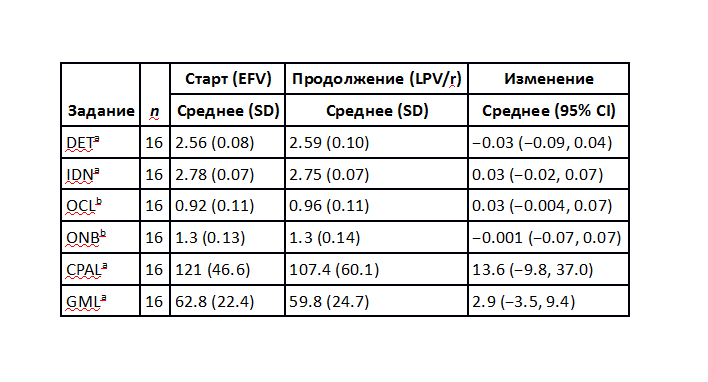
CI – доверительный интервал, EFV – эфавиренц, LPV/r – лопинавир, усиленный ритонавиром, SD – стандартное отклонение.
Обнаружение (DET) и идентификация (IDN): скорость представления (среднее время реакции log10-трансформированное для верных ответов). Обучение по одной карточке (OCL) и задача 1-назад (ONB): аккуратность представления (arcsin-трансформация пропорции верных ответов), тест непрерывного спаренного ассоциативного обучения (CPAL): аккуратность представления (общее число ошибок за пять подходов), изучение лабиринтов Гротона (GML): общее число ошибок допущенных за пять последовательных попыток в одну сессию (Данные для одного пациента за одну задачу за один визит не прошли проверку целостности. Анализ проводился с и без включения этих данных и на итоговый результат это не оказало влияния).
a) Более низкий балл означает лучшее представление, изменение определяется как разница: начальный балл минус последующий балл.
b) Более высокий балл означает лучшее представление и изменение определяется как разница: последующий балл минус начальный балл. Таким образом во всех случаях положительное изменение означает улучшение
Участники были включены в спаренный анализ протонной магнитно-резонансной спектроскопии, где спектральное качество данного вокселя на обоих этапах исследования принималось в следующих значениях: фронтальное белое вещество n=11, фронтальное серое вещество n=14, базальные ганглии n=8. Ни для одного метаболита не было обнаружено изменений ни в одном вокселе в промежутке между стартом и послеующими визитами, со следующими средними изменениями: фронтальное серое вещество Cho/Cre, 0.01 (95% CI: −0.01 to 0.02) and NAA/Cre, 0.16 (95% CI: −0.13 to 0.44); фронтальное белое вещество: Cho/Cre, 0.03 (95% CI: −0.02 to 0.08) and NAA/Cre, 0.11 (95% CI: −0.12 to 0.33); базальные ганглии: Cho/Cre, 0.04 (95% CI: −0.02 to 0.10) and NAA/Cre, 0.03 (95% CI: −0.32 to 0.38)
Талица 2. Мозговые метаболиты. Оценка протонной магнитно-резонансной спектроскопей.
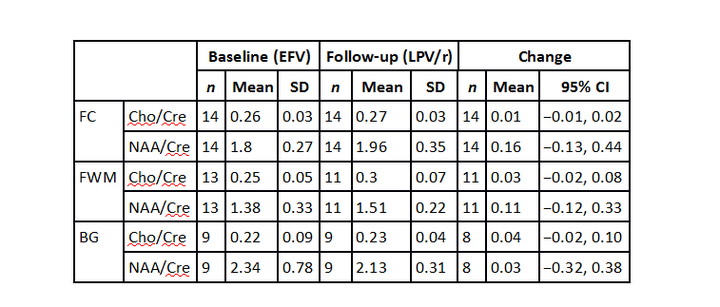
FC… передняя кора (фронтальное серое вещество), FWM фронтальное белое вещество, BG базальные ганглии, Cho – холин, Cre – креатин, NAA, N – ацетиласпартат, CI – доверительный интервал, EFV – эфавиренц, LPV/r – лопинавир, усиленный ритонавиром, SD – стандартное отклонение
Были проанализированы данные fMRI 14 участников. Во-первых, действие теста Струпа на мозговую активность оценивались во время стартового визита для подтверждения того, что используемый протокол fMRI вызывал измеримый и ожидаемый эффект в нашей группе участников. Оценивалась активность во время предъявления несоответствующих стимулов, и сопоставлялись с активностью во время предъявления нейтральных стимулов. Во время задания были определены три участка активации, анатомически представленные в соответствии с ожиданием для данной парадигмы тестов: BA45/BA8/BA46, BA20/BA7/BA40 and BA7 (BA, Brodmann's area; Table S1). Во-вторых, было проведено сравнение мозговой активации в ответ на несоответствующие стимулы, зафиксированной во время обеих контрольных точек (старт, последующий визит) исследования. Изменения мозговой активации связанной со сменой схемы не установлено.
По шкале сна Эпворта (ESS) вообще никаких изменений при переходе с EFV на LPV/r обнаружено не было. (среднее ESS (SD) EFV, 9.8 (5.9); LPV/r, 8.9 (5.1); средняя разница −0.9; 95% CI: −2.7 to 0.9). Данные дневника сна использовались для вычисления средней продолжительности сна на участника за 24-часовой период. В данный анализ были включены пятнадцать участников. Среднее изменение средней продолжительности сна между контрольными точками (старт, последующие визиты) составило 0,1 час (95% C: −0.7 to 1.0 h). Изменение качества сна (PSQI) оценивалось у 14 участников. Средний балл уменьшился, что свидетельствует об улучшении качества сна (среднее (SD): EFV, 8.5 (6.5); LPV/r, 5.8 (5.5); средняя разница−3.4; 95% CI: −6.0 to −0.7). Их семи участников с PSQI > 10 (плохое качество сна) на старте, у 4 на последующих визитах PSQI составили < 10. Более того, не было выявлено связи между стартовыми плазменными концентрациями EFV и стартовыми баллами по GML, ESS или PSQI либо изменений их значений после отмены EFV/
Вирусная нагрузка РНК ВИЧ-1 проверялась во время визитов мониторинга безопасности через 4 недели после смены схемы лечения. На этом этапе три участника (19%) имели ВН > 50 коп/мл, со значениями 69, 107, и 115 коп/мл, соответственно. Во время последующих визитов первые два участника имели вновь подавленную нагрузку до < 50 коп/мл, в то время как третий показал ВН 337коп/мл. Самозаявленная приверженность оценивалась во время каждого из трех последующих визитов, и во время каждого участники указывали на по крайней мере одну пропущенную дозу в неделю. НА старте, три участника (19%) ссылались на диарею (любой степени). Четырнадцать участников предъявляли жалобы на диарею все время после замены EFV на LPV/r (88%) (11 из 13 не заявлявших на старте, 85%). Сведений о серьезных побочных эффектах не зафиксировано.
Обсуждение
Нами проверена гипотеза о связи побочных эффектов со стороны ЦНС с длительной терапией EFV. Насколько нам известно, это первое исследование, в котором контролируемо оцениваются данные об эффекте переключения со схем с EFV на нейрокогнитивную деятельность, мозговые метаболиты, мозговую активность и сон. Несмотря на то, что большая часть участников заявляли симптомы нарушений со стороны ЦНС на старте (включая 81% ссылающихся на проблемы с памятью), мы не обнаружили объективных изменений в нейрокогнитивной деятельности во множестве участков (мозга), мозговых метаболитах, или в мозговой активности. Но при этом отмечено самостоятельно оцениваемое улучшение качества сна (PSQI).
Это было пилотное исследование и потому наши возможности оценить малые влияния были ограничены размерами выборки. Несмотря на это почти по всем изученным параметрам наблюдаемый эффект был близок к нулю и не было тенденций к изменению по всем направлениям (напр., в мозговых метаболитах или когнитивной деятельности). В связи с этим мы можем утверждать, что мы вряд ли упустили какой-либо клинически значимый эффект.
Учитывая, что предшествовавшие исследование демонстрировали побочные эффекты EFV на нейрокогнитивную функцию, что может объяснить результаты наших исследований?
Поскольку предшествовавшие исследования связи когнитивных нарушений и EFV были обзорными и перекрестными по своей природе, их достоверность может быть спорна по причине различий между группами, которые подвергаются воздействию и не подвергаются воздействию EFV. Одно рандомизированное контролируемое исследование, в котором сравнивались EFV и ингибиторы протеазы, было проведено с участием наивных пациентов, только начавших АРТ. В связи с этим превалирующим эффектом были изменения мозговых метаболитов, связанные с подавлением вирусной репликации и восстановлением иммунитета и обнаруженные различия в препаратах не могут рассматриваться вне связи с их воздействием на эти параметры. Хотя большая часть наших участников заявляла о хотя бы некоторых симптомах со стороны ЦНС на старте исследования, те пациенты, которые сталкивались с серьезными нейропсихиатрическими побочными эффектами EFV скорее всего переходили на иные схемы в течение первых месяцев лечения следовательно не были представлены в нашем исследовании. Более того, предшествовавшие исследования смены схем с EFV показывали улучшение симптоматики со стороны ЦНС, но не предполагали объективных измерений показателей ЦНС. Теоретически, уход со схем с EFV мог бы предотвратить ухудшение когнитивных функций, которое так или иначе проявляется, но это представляется маловероятным в рамках нашего короткого по времени исследования. С другой стороны если LPV/r был бы чуть менее эффективным в подавлении вирусной репликации в ЦНС, это потенциально может нивелировать все выгоды от отмены EFV. Мы зафиксировали некоторые «блипы» и пропущенные приемы препаратов после смены схемы. Но еще раз, маловероятно, что это повлияло бы на ЦНС в заявленных рамках исследования. Но к этому необходимо вернуться в следующих исследованиях с включением исследования вирусной нагрузки в спинномозговой жидкости. Последнее, что может дать объяснение - длительная терапия EFV может вызвать умеренные но постоянные затруднения в функционировании ЦНС (в том числе как результат потери нейронов), невосполнимых после смены терапии. Мы обследовали около половины участников с умеренными когнитивными нарушениями на старте исследования, но данное исследование не позволяет установить связано ли это с EFV или с другими факторами. На этот вопрос может дать ответ только длительное рандомизированное контролируемое исследование.
В заключении отметим, что наше исследование не нашло подтверждения острым обратимым эффектам EFV на метаболиты ЦНС или когнитивную функцию у стабильных в другом отношении пациентов. Это должно быть подтверждено другими рандмизированными исследованиями.
Авторы: B Payne; TJ Chadwick; A Blamire; KN Anderson; J Parikh; J Qian; AM Hynes; J Wilkinson; DA Price
Оригинал: Does Efavirenz Replacement Improve Neurological Function in Treated HIV Infection?
Перевод: Денис Чигиринов.
Сокращённый вариант статьи: Гипотеза о нейротоксичности эфавиренза – миф или реальность?



